Diagnose
Aneurysmatisches Dermatofibrom
(Synonyme: Eisenspeicherndes Histiozytom, hämosiderotisches oder hämorrhagisches Histiozytom) mit atypischen Merkmalen
DISKUSSION
Das aneurysmatische Dermatofibrom (AD) gehört zur großen Gruppe der fibrohistiozytären Tumoren. Diese zeichnen sich durch eine große Variabilität der klinischen und histopathologischen Merkmale aus. Da es in den letzten Jahrzehnten zu zahlreichen Umbenennungen ähnlicher Entitäten gekommen ist, ist die korrekte terminologische Einordnung von Tumoren mit fibrohistiozytärer Morphologie häufig schwierig.
Zelger und Zelger veröffentlichten 1998 eine Einteilung der Dermatofibrome (beziehungsweise Histiozytome) in Dermatofibrome mit architektonischen Besonderheiten, Dermatofibrome mit zellulären oder stromalen Besonderheiten, Dermatofibrome mit architektonischen und zellulären oder stromalen Besonderheiten und komplexe oder zusammengesetzte Dermatofibrome. (1)
Im Jahr 2005 wurde eine neue WHO-Klassifikation eingeführt, welche die kutanen fibrohistiozytären Tumoren in gutartige, intermediäre und bösartige Läsionen einteilte. Im Jahr 2006 erfolgte dann im neuen WHO-Band „Skin Tumours“ eine aktualisierte Einteilung der fibrohistiozytären Tumoren, die neue Entitäten wie beispielsweise das pleomorphe Fibrom und die infantileMyofibromatose einschloss. (2)
Im Jahr 2013 erfolgte eine weitere Aktualisierung der WHO-Klassifikation, wobei sich im Bereich der fibrohistiozytären Tumoren als entscheidende Änderung das Verschwinden der Bezeichnung „maligne fibröse Histiozytome“ ergab. (3,4)
In der neusten Aktualisierung von 2023 werden die Dermatofibrome in folgende Subtypen eingeteilt: Das klassische, das zelluläre, das aneurysmatische und das atypische Dermatofibrom sowie das tiefe fibröse Histiozytom. (5)
Insgesamt kann festgestellt werden, dass die Kategorie der sogenannten fibrohistiozytären Tumoren im Verlauf der letzten drei Aktualisierungen der entsprechenden WHO-Klassifikation die meisten Tumorentitäten verloren hat. Dies ist unter anderem darauf zurückzuführen, dass einige Tumoren aufgrund molekularer Befunde anderen Differenzierungslinien zugeordnet wurden, dass das Konzept der fibrohistiozytären Differenzierung schwer zu fassen ist und dass die histiozytäre Komponente in diesen Tumoren nicht neoplastischer Natur ist. (6)
Dermatofibrome entstehen oft nach einem Insektenstich, Trauma oder einer Follikulitis. Am häufigsten treten diese bei jungen Frauen an den unteren Extremitäten auf. Es finden sich hiermeist feste, rotbraune, kleine Papeln oder Nodi, die aus fibroblastischem Gewebe bestehen und zu den mesenchymalen Neoplasien der Haut gehören. Meist handelt es sich um singuläre Läsionen, wobei in seltenen Fällen auch multiple Dermatofibrome auftreten können. Letzteres kann mit verschiedenen Grunderkrankungen wie beispielsweise dem humanen Immundefizienz-Virus (HIV), systemischen Lupus erythematodes (LE) und Infektionen assoziiert sein. (7)
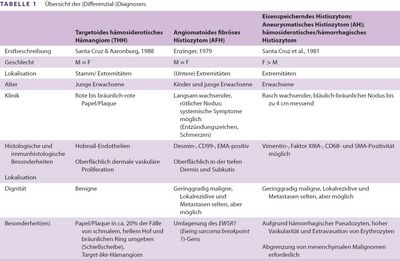
Im Falle unserer Patientin war die Läsion sowohl aufgrund des ungewöhnlichen klinischen Bildes als auch infolge histopathologischer Merkmale schwierig einzuordnen. Aufgrund des anamnestisch angegebenen klinischen Bildes (hämatomartig) wurde zunächst auch ein, erstmals 1988 von Santa Cruz beschriebenes, targetoides hämosiderotisches Hämangiom (THH) in Betracht gezogen. (8) Hierbei handelt es sich um einen blutgefüllten, vorwiegend lymphatischen, gutartigen und eher oberflächlich lokalisierten Gefäßtumor. Dieser tritt meist am Stamm oder den Extremitäten bei jungen Erwachsenen ohne Geschlechtsprävalenz auf und wird klinisch häufig mit einem Dermatofibrom, einem Kaposi-Sarkom oder sogar mit einem Melanom verwechselt. (9) Histologisch finden sich hier auch interstitielle Erythrozytenextravasate und Siderophagen.
Der Tumor unserer Patientin war hingegen tief beziehungsweise bis in die Subkutis reichend gelegen und zeigte oberflächlich ein deutliches collagen entrapment, was zusammen mit dem klinischen Bild gegen ein THH und eher für ein Dermatofibrom sprach. Atypisch waren jedoch die klinisch und histologisch relativ gut umschriebene, noduläre Tiefenausdehnung des Tumors sowie der klinisch entzündliche Aspekt des Knotens, der auch an die Möglichkeit eines angiomatoiden fibrösenHistiozytoms (AFH) denken ließ.
Das AFH wurde erstmals 1979 von Enzinger in einer Fallserie mit 41 Fällen beschrieben. (10) Diese als potenziell niedrig maligne klassifizierten Tumoren treten meist bei Kindern und jungen Erwachsenen an den unteren Extremitäten auf. (11–13) Eine vollständige Resektion wird angestrebt, um Lokalrezidive oder Metastasen zu verhindern. Nach vollständiger Exzision ist die Prognose sehr gut. In 2%–12 % kommt es zu Lokalrezidiven und in weniger als 1% der Fälle zu Fernmetastasen. Die Tumorzellen sind in der Immunhistochemie häufig positiv für Desmin, CD99 und EMA. (13) Das AFH zählt zu den Weichgewebetumoren, die eine Umlagerung des EWSR1 (Ewing sarcoma breakpoint 1)-Gens aufweisen. Lokalisiert ist dieses Gen auf Chromosom 22q12. Eine EWSR1-CREB1-Fusion ist in über 90% der Fälle nachweisbar. (14) Diemolekulargenetische Untersuchung war bei unserer Patientin aus technischen Gründen leider nicht möglich. Gleichwohl ließ sich hier ein AFH ausschließen, da in unserem Fall die typische pseudokapselartige Umhüllung, ein pleomorphes Zellbild und das entsprechende immunhistochemische Expressionsverhalten fehlten. (Die Läsion bei unserer Patientin war negativ für Desmin und EMA.)
Der hier vorgestellte Tumor entspricht morphologisch einem aneurysmatischen Dermatofibrom (AD). In der Literatur wird AD als Synonym für das aneurysmatischeHistiozytom (AH), das eisenspeichernde Histiozytom oder auch das hämosiderotische oder hämorrhagische Histiozytom genannt. Der Begriff aneurysmatisch ist jedoch irreführend, da es sich nicht um erweiterte Gefäße, sondern um pseudovaskuläre Hohlräume handelt, die durch die massive Einblutungen respektive Eisenspeicherung auf den ersten Blick erweiterte Gefäße imitieren. Beim AD handelt es sich um eine weitere Variante der fibrösen Histiozytome, die in weniger als 2% der Fälle auftritt und erstmals 1981 von Santa Cruz et al. beschrieben wurde. (15) Klinisch zeigt sich hier ein bläulich-bräunlicher, oft rasch wachsender Knoten, der aufgrund des variablen Farbspektrums an einen Regenbogen erinnern kann und bevorzugt im mittleren Erwachsenenalter auftritt. Histologisch handelt es sich bei AD im Gegensatz zu unserem Fall um eher oberflächliche Tumoren, die immunhistologisch positiv für Vimentin sind und eine fokale Expression von Faktor XIIIA, CD68 und SMA aufweisen können. (16) Die Therapie der Wahl ist beim AH eine vollständige Exzision, wobei es jedoch in bis zu 19% der Fälle zu einem Rezidiv und in Einzelfällen auch zu Metastasen kommen kann. (17,18) Da bis jetzt weder für das AFH noch für das AD einheitliche Empfehlungen bezüglich Sicherheitsabständen zur Verringerung von Rezidiven noch zu den erforderlichen Nachsorgen vorhanden sind, müssen betroffene Patienten ausführlich aufgeklärt und informiert werden, dass bei neuen Hautveränderungen zeitnahe dermatologische Vorstellungen indiziert sind.
Der Fall unserer Patientin weist eine deutliche Diskrepanz zwischen dem klinischen, anamnestischen und histologischen Befund auf. Obwohl der hämatomartige Beginn, die später auch zum Zeitpunkt der Exzision bestehenden Entzündungszeichen (Druckschmerzhaftigkeit und Überwärmung) sowie der rötlich-livide Farbton des tief in die Subkutis reichenden Tumors durchaus an ein AFH denken ließen, haben wir dennoch in Anbetracht der histologischen und immunhistologischen Befunde die Diagnose eines aneurysmatischen Dermatofibroms gestellt, welches klinisch und histologisch atypische Merkmale aufweist.
Das klassische AD (Syn.: eisenspeicherndes/hämosiderotisches/hämorrhagisches Dermatofibrom) imponiert klinisch üblicherweise als bräunlichbläulicher, symptomloser Knoten ohne Entzündungszeichen (Tabelle 1). Die uneinheitliche Nomenklatur mit zahlreichen, teilweise irreführenden Synonymen für ein und dieselbe Entität hat die Diagnosefindung beziehungsweise exakte terminologische Zuordnung in diesem Fall zusätzlich erschwert. Die Terminologie der fibrohistiozytären Tumoren bedarf nach unserer Einschätzung einer Vereinheitlichung.
Zusammenfassend verdeutlicht unser Fall, wie komplex die Diagnostik der Tumoren aus dem Spektrum der Dermatofibrome sein kann und dass sie bisweilen nur unter korrelierender Berücksichtigung klinischer, histologischer, immunhistologischer und gegebenenfalls molekularpathologischer Merkmale gelingt.
Interessenkonflikt:
Keiner.
LITERATUR
1. Zelger BG, Zelger B. Dermatofibrome: Ein klinisch-pathologisches Klassifikationsschema. Pathologe. 1998;19:412-419.
2. Hügel H. Fibrohistiocytic skin tumors. J Dtsch Dermatol Ges. 2006;4(7):544-554.
3. Doyle LA. Sarcoma classification: an update based on the 2013World Health Organization Classification of Tumors of Soft Tissue and Bone. Cancer. 2014;120(12):1763-1774.
4. Jo VY, Fletcher CD. WHO classification of soft tissue tumours: An update based on the 2013 (4th) edition. Pathology. 2014;46(2):95-104.
5. WHO Skin Tumours 5th edition online only 2023. Available from: tumourclassificationiarcwhoint/welcome/ #[Last accessed Juni 30, 2023].
6. Sbaraglia M, Bellan E, Dei Tos AP. The 2020 WHO classification of soft tissue tumours: news and perspectives. Pathologica. 2021;113(2):70.
7. Seifi G, Kalantari Y, Etesami I. Multiple dermatofibromas, associated clinical and histological characteristics: A systematic review. J Dtsch Dermatol Ges. 2022;20(12):1569-1579.
8. Santa Cruz DJ, Aronberg J. Targetoid hemosiderotic hemangioma. J Am Acad Dermatol. 1988;19(3):550-558.
9. Sahin M, Demir M, Gunduz K, et al. Targetoid haemosiderotic haemangioma: dermoscopic monitoring of three cases and review of the literature. Clin Exp Dermatol. 2005;30(6):672-676.
10. Enzinger FM. Angiomatoid malignant fibrous histiocytoma. A distinct fibrohistiocytic tumor of children and young adults simulating a vascular neoplasm. Cancer. 1979;44(6):2147-2157.
11. Wilk M, Zelger BG, Debiec-Rychter M, et al. Angiomatoid firbous histiocytoma-case series with emphasis on a late fibrotic variant. J Dtsch Dermatol Ges. 2015;13(5):441-448.
12. Boland JM, Folpe AL. Cutaneous neoplasms showing EWSR1 rearrangement. Adv Anat Pathol. 2013;20(2):75-85.
13. Kao YC, Lan J, Tai HC, et al. Angiomatoid fibrous histiocytoma: clinicopathological and molecular characterisation with emphasis on variant histomorphology. J Clin Pathol. 2014;67(3):210-215.
14. Fisher C. The diversity of soft tissue tumours with EWSR 1 gene rearrangements: A review. Histopathology. 2014;64(1):134-150.
15. Santa Cruz DJ, Kyriakos M. Aneurysmal (“angiomatoid”) fibrous histiocytoma of the skin. Cancer. 1981;47(8):2053-2061.
16. Guillou L, Gebhard S, Salmeron M, Coindre J-M.Metastasizing fibrous histiocytomaof the skin: a clinicopathologic and immunohistochemical analysis of three cases. Mod Pathol. 2000;13(6):654-660.
17. Calonje E, Fletcher C. Aneurysmal benign fibrous histiocytoma: clinicopathological analysis of 40 cases of a tumour frequentlymisdiagnosed as a vascular neoplasm. Histopathology. 1995;26(4):323-331.
18. Wood KA, Easson AM, Ghazarian D, Saeed Kamil Z. Metastatic aneurysmal fibrous histiocytoma in a 20-year-old woman: a rare case report with review of the literature and discussion of its genomic features. J Cutan Pathol. 2020;47(9):870-875.

Die Diagnosequizze werden uns freundlicherweise zur Verfügung gestellt vom
"Journal der Deutschen Dermatologischen Gesellschaft" © Deutsche Dermatologische Gesellschaft
![Logo: Junge Dermatologen im Berufsverband der deutschen Dermatologen - zur Startseite [ALT+1]](/typo3conf/ext/judermconfig/Resources/Public/Images/Branding/JuDermLogo.png?v=2)