Diagnose
23. Mai 2025
Diagnose: ADA2-Vaskulopathie
DISKUSSION
Aufgrund der Multiorganbeteiligung wurde eine genetische Ursache in Betracht gezogen. In der genetischen Untersuchung (whole genome sequencing) zeigten sich zwei compound-heterozygote Varianten im Adenosin-Deaminase-2-Gen (ADA2) (ADA2, NM_001282225.1, c.140G>C, p.(Gly47Ala), chr22:17690428C>G (hg19) und c.245C>A, p.(Pro82His), chr22:17690323G>T (hg19)).
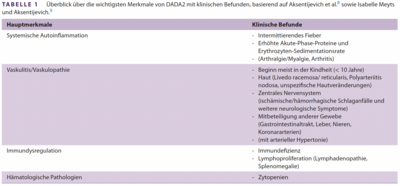
Beide Varianten wurden gemäß den Richtlinien des American College of Medical Genetics and Genomics (ACMG) als möglicherweise pathogen klassifiziert. Die Symptome der Patientin interpretierten wir im Zusammenhang mit einer hereditären ADA2-Defizienz (DADA2). Diese stellt eine seltene, autosomal-rezessiv vererbte, monogenetische autoinflammatorische Erkrankung dar, die durch biallelische pathogene Varianten im ADA2-Gen (OMIM: 615688, ehemals CECR1) verursacht wird. DADA2 führt zu vaskulitischen und vaskulopathischen Manifestationen in unterschiedlichen Organen, hämatologischen Erkrankungen und einer Immundysregulation (1–3). Die Krankheit wurde erstmals 2014 von Zhou et al. Bei drei Kindern beschrieben, die unter Multiorganbeteiligung litten. Die Symptome umfassten wiederkehrendes Fieber, Schlaganfälle, livedoide Hautveränderungen, erhöhte Akutphasen-Proteine, Hepatosplenomegalie und Hypogammaglobulinämie (1). Klinische Befunde, die auf die Diagnose hindeuten sollten, sind in Tabelle 1 zusammengefasst, formale Diagnosekriterien gibt es noch nicht.
Die Erkrankung ist mit einer verstärkten Typ-I-Interferon (IFN)-Antwort assoziiert, die eine Aktivierung von Immunzellen und die Produktion proinflammatorischer Zytokine bewirkt, der Tumornekrosefaktor (TNF) spielt dabei eine zentrale Rolle bei den immunologischen Veränderungen (1,4,5). Dieser Entzündungsprozess trägt vermutlich zur ZNS-Vaskulopathie bei, die sowohl lakunäre ischämische als auch hämorrhagische Schlaganfälle verursachen kann. Diese treten typischerweise vom Kindes- bis ins junge Erwachsenenalter auf (1). Die klinischen Symptome variieren je nach Lokalisation der Schlaganfälle, während Zeichen einer Vaskulitis der großen Gefäße in der Regel, wie auch bei unserer Patientin, fehlen.
Zudem können weitere Komplikationen wie Läsionen der Hirnnerven, periphere Neuropathien, Verschlüsse der Netzhautarterien oder Hörverlust auftreten. Die Multiorganbeteiligung bei DADA2 könnte durch alters- und immunstatusbedingte Unterschiede in der ADA2-Proteinexpression beeinflusst werden (2). Darüber hinaus stehen ADA2-Mutationen selten im Zusammenhang mit dem Sneddon-Syndrom, einer Vaskulopathie der mittelgroßen und kleinen Gefäße. Aufgrund ihrer Heterogenität kann die Abgrenzung dieser beiden Erkrankungen schwierig sein. Das Sneddon-Syndrom äußert sich typischerweise im jungen Erwachsenenalter mit generalisierter, schmerzloser Livedo racemosa und zerebrovaskulären Ereignissen (6).
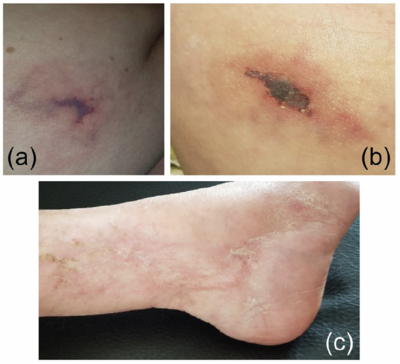
Nach der genetischen Diagnostik begannen wir eine Therapie mit dem TNF-Antikörper Adalimumab (40 mg subkutan alle 14 Tage). Diese führte zu einer deutlichen Verbesserung der kutanen Manifestationen und Stabilisierung neurologischer Symptome. Allerdings entwickelte die Patientin einige Monate nach Beginn der Therapie reproduzierbare Nekrosen, Blutungen und blitzartige erythematöse Hautveränderungen an den Injektionsstellen (Abbildung 2a,b). Daraufhin stellten wir die Behandlung auf Infliximab um (3 mg/kg Körpergewicht i.v., verabreicht in den Wochen 0, 2 und 6 sowie anschließend alle 8Wochen), was innerhalb von 5 Monaten zur Abheilung der Ulzerationen führte, ohne dass neue vaskulopathische Läsionen auftraten (Abbildung 2c).
Dieses Ergebnis steht im Einklang mit Literaturberichten, die zeigen, dass eine systemische immunmodulatorische Therapie mit TNF-Inhibitoren eine rasche Verbesserung der kutanen Symptome bewirken kann (2). Die Entwicklung von Hautnekrosen nach der subkutanen Anwendung von Adalimumab könnte durch eine lokal verstärkte Typ-I-Interferon (IFN)-Antwort erklärt werden (7). Weniger wahrscheinlich handelt es sich um eine lokale Reaktion unabhängig vom Wirkstoff selbst (Koebner-Phänomen) (6). Mit diesem Bericht über diese seltene Erkrankung möchten wir die Bedeutung genetischer Ursachen bei therapierefraktären, komplexen klinischen Verläufen mit Multiorganbeteiligung hervorheben. Genetische Untersuchungen können nicht nur zur Diagnose der Erkrankung beitragen, sondern auch helfen therapeutische Zielstrukturen identifizieren. Dabei ist zu beachten, dass vaskuläre Veränderungen nicht nur durch die Grunderkrankung, sondern auch als Nebenwirkung therapeutischer Interventionen entstehen können. Das Verständnis der Pathomechanismen – einschließlich genetischer Diagnostik – ist entscheidend, um fundierte, interdisziplinäre Therapieentscheidungen zu treffen und potenzielle Nebenwirkungen adäquat zu managen.
INTERESSENKONFLIKT
Keiner.
LITERATUR
- Zhou Q, Yang D, Ombrello AK, et al. Early-onset stroke and vasculopathy associated with mutations inADA2.NEnglJMed. 2014;370:911-920. Barron KS, Aksentijevich I, Deuitch NT, et al. The Spectrum of the Deficiency
- of Adenosine Deaminase 2: An Observational Analysis of a 60 Patient Cohort. Front Immunol. 2021;12:811473.
- Navon Elkan P, Pierce SB, Segel R, et al.Mutant adenosine deaminase 2 in a polyarteritis nodosa vasculopathy.NEnglJMed. 2014;370:921-931.
- Yarilina A, Ivashkiv LB. Type I interferon: a new player in TNF signaling. Curr Dir Autoimmun. 2010;11:94-104.
- Signa S, Bertoni A, Penco F, et al. Adenosine Deaminase 2 Deficiency (DADA2): A Crosstalk Between Innate and Adaptive Immunity. Front Immunol. 2022;13:935957.
- Bras J, Guerreiro R, Santo GC. Mutant ADA2 in vasculopathies. N Engl J Med 2014;371:478-480.
- Cantaert T, Baeten D, Tak PP, van Baarsen LG. Type I IFN and TNFalpha cross-regulation in immune-mediated inflammatory disease: basic concepts and clinical relevance. Arthritis Res Ther. 2010;12:219.
- Aksentijevich I, Sampaio Moura N, Barron K. Adenosine Deaminase 2 Deficiency. In: Adam MP, Feldman J, Mirzaa GM, et al, eds. GeneReviews((R)). Seattle (WA). 1993.
- Meyts I, Aksentijevich I. Deficiency ofAdenosine Deaminase 2 (DADA2): Updates on the Phenotype, Genetics, Pathogenesis, and Treatment. J Clin Immunol. 2018;38:569-578.

Die Diagnosequizze werden uns freundlicherweise zur Verfügung gestellt vom
"Journal der Deutschen Dermatologischen Gesellschaft" © Deutsche Dermatologische Gesellschaft
![Logo: Junge Dermatologen im Berufsverband der deutschen Dermatologen - zur Startseite [ALT+1]](/typo3conf/ext/judermconfig/Resources/Public/Images/Branding/JuDermLogo.png?v=2)