Wie plane ich ein eigenes Projekt
24. Dezember 2021
Klinische Studien sind eine wesentliche Grundlage für den medizinischen Fortschritt und die Voraussetzung für evidenzbasierte Medizin. Wichtig ist, dass die untersuchte Fragestellung klinisch relevant ist und die in der entsprechenden Studie erhobenen Daten korrekt, replizierbar und nachvollziehbar sind. Sind diese Bedingungen erfüllt, können die erhobenen Ergebnisse dazu beitragen, Therapieempfehlungen zu beeinflussen, sowie neue diagnostische Verfahren in die Praxis einzuführen und zu etablieren.
Prinzipiell gibt es medizinische Primär- und Sekundärforschung. Unter Sekundärforschung fallen beispielsweise Reviews und Metaanalysen. Die Primärforschung umfasst dann die eigentlichen Studien. Hier können wiederum drei Hauptbereiche unterschieden werden: medizinische Grundlagenforschung, klinische und epidemiologische Forschung.
In den Klinik- und Praxisalltag sind vor allem klinische Studien gut integrierbar. Klinische Studien können sowohl interventioneller als auch nicht interventioneller Natur sein und sind nach dem Arzneimittelgesetz (AMG) definiert als „…jede am Menschen durchgeführte Untersuchung, die dazu bestimmt ist, klinische oder pharmakologische Wirkungen von Arzneimitteln zu erforschen oder nachzuweisen oder Nebenwirkungen festzustellen oder die Resorption, die Verteilung, den Stoffwechsel oder die Ausscheidung zu untersuchen, mit dem Ziel, sich von der Unbedenklichkeit oder Wirksamkeit der Arzneimittel zu überzeugen“ (2). Bei der nicht interventionellen Prüfung (NIS) erfolgt die Behandlung einschließlich der Diagnose und Überwachung ausschließlich nach der aktuellen ärztlichen Praxis – also leitliniengerecht.
Die Durchführung einer klinischen Studie sollte nach den verbindlichen Regeln von „Good Clinical Practice“ (GCP) erfolgen (3). Entsprechend der aktuellen Empfehlung der Bundesärztekammer ist hier eine Schulung erforderlich - sowohl für uns Ärzt:Innen, als auch für die an der Durchführung beteiligten Study Nurses. Für Ärzt:Innen, die darüber hinaus auch als verantwortliche Prüfer bzw. Stellvertreter eine Prüfstelle leiten werden, ist zusätzlich die Teilnahme an einem Aufbaukurs vorgeschrieben. Vermittelt werden hier unter anderem regulatorische Grundlagen (ethische und rechtliche Grundlagen), methodische Grundlagen (zum Beispiel Arzneimittelentwicklung), der Ablauf einer Studiendurchführung nach GCP (Aufklärung und Einwilligung, Prüfplan, Prüfpräparate, Dokumentation, Arzneimittelsicherheit, Qualitätskontrolle).
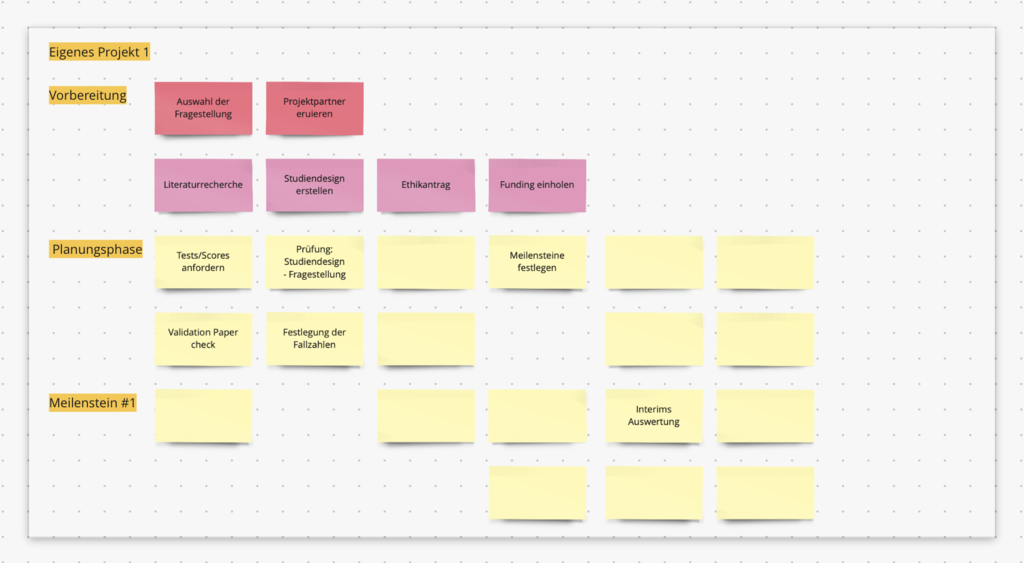
Im Rahmen der Vorbereitungsphase eines klinischen Projekts haben wir nun eine Literaturrecherche durchgeführt, eine Fragestellung formuliert, das geeignete Studiendesign gewählt, einen Projektplan verfasst und geeignete Projektpartner akquiriert… dann ist ein großer Meilenstein der Vorbereitung und Planung bereits erreicht. Nun folgt der Ethikantrag.
Nicht nur die klinische Standardversorgung, die der bestmöglichen Behandlung des individuellen Patienten dient (Prinzip des Wohltuns), auch die Forschung ist den medizinethischen Prinzipien Wohltun, Nichtschaden, Respekt vor der Autonomie und Gerechtigkeit verpflichtet (4). Allerdings bedarf es aufgrund der Besonderheiten von medizinischer Forschung mit Menschen einer weitergehenden Klärung, was in diesem Kontext ethisch vertretbar ist.
Forschungsvorhaben in der Medizin sind je nach Studientyp mit bestimmten Risiken für die Studienteilnehmer verbunden. Nun beinhaltet auch eine Standardtherapie Risiken, etwa die der unerwünschten Nebenwirkungen. Im Kontext der Forschung müssen zwei wesentlichen Merkmale herausgestellt werden:
- den Risiken der Forschung muss eine andere Verteilung des zu erwartenden Nutzens gegenüberstehen
- Forschungsvorhaben bergen eine erhöhte Ungewissheit hinsichtlich des möglichen Nutzens und Risikos
Das Instrumentalisierungsverbot bzw. die Menschenwürde bilden das ethische Fundament der medizinischen Forschung mit Menschen. Folglich dürfen die Interessen von Wissenschaft und Gesellschaft ohne weitere Abwägung keinen Vorrang vor den Rechten und Bedürfnissen des Einzelnen haben. Um den ethischen Konflikt der medizinischen Forschung in der Praxis zu vermitteln, bedarf es eines Konsensus dazu, unter welchen Bedingungen Forschung mit Menschen als ethisch akzeptabel beurteilt werden kann. Diese Bedingungen wurden vielfach in Guidelines und Deklarationen festgehalten. Hieraus leiteten Emanuel et al. ein für die Forschungsethik maßgebendes Framework ab (5). Es beinhaltet unter anderem folgende Prinzipien: sozialer Wert, wissenschaftliche Validität, faire Auswahl der Studienteilnehmer, günstiges Nutzen-/Risiko-Verhältnis, unabhängige Begutachtung, informierte Einwilligung/informed consent.
Zu guter Letzt will auch die (statistische) Auswertung gut geplant sein. Nicht nur das zu untersuchende Kollektiv, sondern auch die Kontrollgruppe sollte für die Beantwortung der wichtigsten Fragestellungen der Studie geeignet sein. Zu einem guten Studiendesign zählt folglich eine adäquate Fallzahlplanung. Diese ermöglicht, dass der angenommene (Therapie-)Effekt mit einer vorher festgelegten Wahrscheinlichkeit („Power“) auch als solcher erkannt wird – also statistisch signifikant ist. Über hinreichende Statistikkenntnisse sollte jeder von uns verfügen – sind sie nicht erst im Rahmen eigener (klinischer) Studien relevant, sondern sollten auch regelhaft in der klinischen Standardversorgung zur Anwendung kommen. Grundsätzlich empfiehlt sich zudem mindestens die Beratung durch ein Institut für Medizinische Biometrie, Informatik und Epidemiologie. Prinzipiell sollte immer der höchstmögliche Grad an Verblindung gewählt werden. Der Studienstatistiker sollte bis zur endgültigen Festlegung der Auswertungsdetails ebenfalls verblindet bleiben.
Zugunsten der didaktischen Klarheit möchte ich nun zum Fazit kommen und Themen wie die Durchführung und Auswertung eines eigenen Projekts in zukünftigen Artikeln thematisieren.
Jedes eigene Projekt, insbesondere das erste, will gut durchdacht und geplant sein. Ein Projektplan sollte alle Eckdaten wie Titel, Hintergrund, Ziel des Projekts, Methoden, Patientenkollektiv, Fallzahlen, sowie die zu verwendende statistische Methodik umfassen.
Neben dem Zugewinn fachlicher Kompetenz für uns junge Assistent:Innen bietet das Format der Projektarbeit auch die Möglichkeit der Erweiterung unserer Soft Skills.
In diesem Sinne wünsche ich Euch allen in diesem letzten Artikel vor der Weihnachtspause eine besinnliche Weihnachtszeit im Kreise Eurer Liebsten und freue mich darauf, auch im neuen Jahr viele spannende Themen mit Euch erkunden zu dürfen.
Eure Regina
Referenzen:
1 Dtsch Arztebl Int 2009; 106(15): 262-8; DOI: 10.3238/arztebl.2009.0262
2 Arzneimittelgesetz (AMG) § 4 Abs. 23
3 Schumacher M, Schulgen G: Methodik klinischer Studien. 2. Aufl. Berlin, Heidelberg, New York: Springer 2007; 1–436
4 Beauchamp TL, Childress JF. Principles of Biomedical Ethics. 8th Edition. New York: Oxford University Press; 2019
5 Emanuel EJ, Wendler D, Grady C. An Ethical Framework for Biomedical Research. In: Emanuel EJ et al., (Eds) The Oxford Textbook of Clinical Research Ethics. New York: Oxford University Press; 2008: p. 123–135
![Logo: Junge Dermatologen im Berufsverband der deutschen Dermatologen - zur Startseite [ALT+1]](/typo3conf/ext/judermconfig/Resources/Public/Images/Branding/JuDermLogo.png?v=2)